WB 实验关键点
WB实验流程
WB 实验流程通常包括样本制备、电泳、转膜、封闭、抗体孵育和检测 6 个部分(图1)。这 6 个部分是环环相扣,每一步的疏忽都可能导致一无所获。
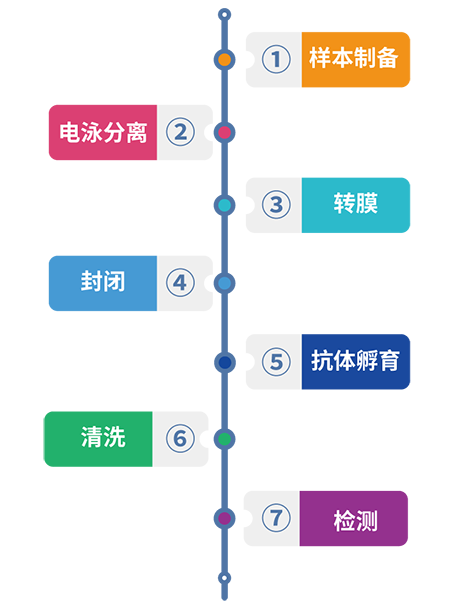
图1.WB实验流程
样本选择和处理
蛋白分子参与生命活动的各个过程,其功能复杂多样,有些蛋白可能只在部分组织和细胞表达(图2)。有些蛋白可能需要诱导,才能表达或表达量增加(图3)。有些蛋白可能存在翻译后修饰,导致其蛋白分子量大小可能与预测不符(图3,4)。有些蛋白可能有多个异构体或者容易被降解,导致出现多条条带的现象(图3)。因此,只有足够了解您研究的蛋白特性,您才能在样本的选择和处理上得心应手,美美的开启您的 WB 之旅。
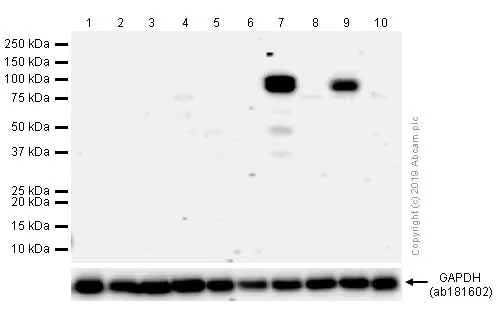
图2. MMP9 在不同细胞系表达水平不同。
Lane 1: | LoVo 全细胞裂解液 |
Lane 2: | Huh7 全细胞裂解液 |
Lane 3: | MCF7 全细胞裂解液 |
Lane 4: | HeLa 全细胞裂解液 |
Lane 5: | Caco-2 全细胞裂解液 |
Lane 6: | A549(血清饥饿诱导过夜)全细胞裂解液 |
Lane 7: | A549(血清饥饿诱导过夜,80nM TPA 处理24小时)全细胞裂解液 |
Lane 8: | MDA-MB-231(血清饥饿诱导过夜)全细胞裂解液 |
Lane 9: | MDA-MB-231(血清饥饿诱导过夜后,200nM TPA 处理 24 小时)全细胞裂解液 |
Lane 10: | HepG2 全细胞裂解液 |
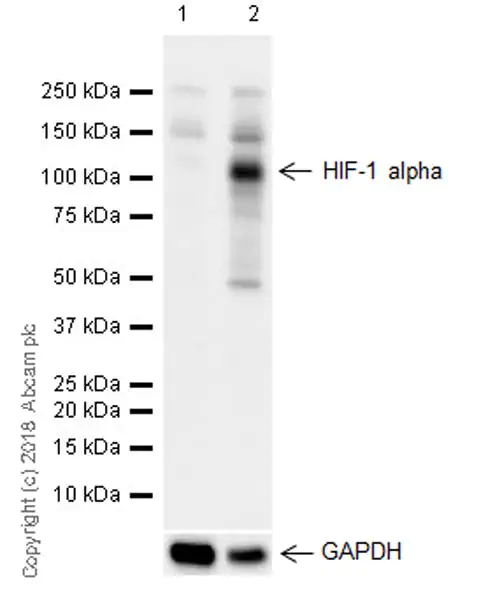
图3.在 HeLa 细胞中 HIF-1 alpha
蛋白需低氧诱导才表达。
Lane 1:
未处理C6 (rat glial tumor glial cell)全细胞裂解液
Lane 2:
400 µM CoCl2 和 200 µM MG-132 (☞ab141003)处理4小时后的 C6 全细胞裂解液。
预测分子量: 92 kDa;检测到分子量: 110 kDa。
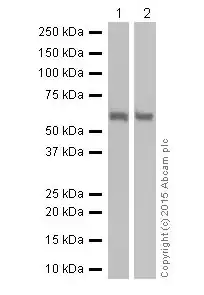
图4.SQSTM1 / p62 蛋白
Lane 1:
人肝脏裂解液
Lane 2:
人肾脏裂解液
预测分子量: 47 kDa;检测到分子量: 62 kDa
样本制备
样本制备是 WB 实验的开端,裂解液的选择、样本的破碎方法、温度和变性等都会影响样本制备是否成功。
小艾根据多年经验,整理了一些样本制备过程中需关注的小细节:
1 | 添加复合蛋白酶抑制剂以避免靶标蛋白降解。如果涉及蛋白修饰的检测,需添加相应的去修饰酶抑制剂,例如对于磷酸化修饰蛋白添加复合磷酸酶抑制剂,以防止蛋白在提取时被去磷酸化。 |
2 | 选择合适的裂解液来富集更多靶标蛋白。 |
3 | 超声破碎处理细胞以富集更多靶标蛋白(图5)。 |
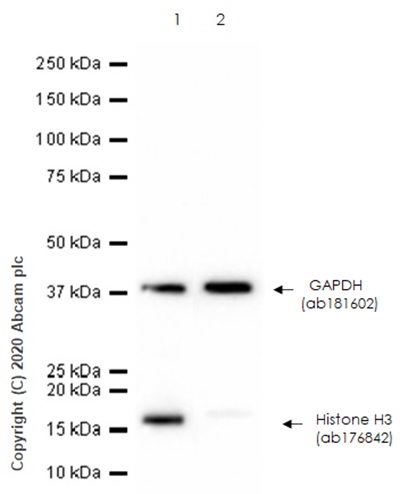
图5.超声处理富集 THP-1 细胞中的
Histone H3 蛋白
Lane 1:
超声处理 THP1 全细胞裂解液
Lane 2:
未处理 THP-1 全细胞裂解液
4 | 整个样本制备过程中,保持样本置于冰上。 |
5 | 一般来说,95℃ 变性 5-10min。对于有些多次跨膜蛋白,37℃ 或者 70℃ 10min 可能效果更好。 |
6 | 通过 Bradford 分析、Lowry 分析或 BCA 分析测定样本蛋白浓度。 |
电泳
电泳可以将靶标蛋白与其它蛋白分开,更易检测。不同浓度的分离胶对不同分子量的蛋白分离效果是不同的。蛋白的上样量,也会影响是否可以检测到有效信号或者获得漂亮的图片。设置阳性和阴性对照不仅有助于分析蛋白功能,在 WB 实验失败时也有助于分析失败的原因。
小艾在电泳时会特别关注以下小细节:
1 | 根据蛋白大小选择合适的电泳胶浓度,以确保不同蛋白的迁移速率与分离程度最优。具体可参考表1。 |
蛋白的分子量大小 | 分离凝胶丙烯酰胺百分比 |
4–40 kDa | 20% |
12–45 kDa | 15% |
10–70 kDa | 12.5% |
15–100 kDa | 10% |
25–200 kDa | 8% |
表1.不同浓度的分离胶选择
2 | 对于分子量较小的靶标蛋白(如分子量<25 kDa),请使用较高浓度的分离胶进行电泳。 |
3 | 对于分子量较大的靶标蛋白(如分子量>100 kDa),请使用较低浓度的分离胶进行电泳。 |
4 | 至少上样 20μg 总蛋白进行电泳。 |
5 | 建议使用阳性和阴性对照。 |
转膜
转膜是指将蛋白从电泳胶上转移到膜上,方便目标蛋白的检测。转膜缓冲液中 SDS 和甲醇含量对不同分子量蛋白的转膜影响是不同的(图6)。PVDF 膜孔径的选择依赖于蛋白分子量大小。转膜结束后,丽春红染色使蛋白可视化,方便判断转膜是否成功(图7)。
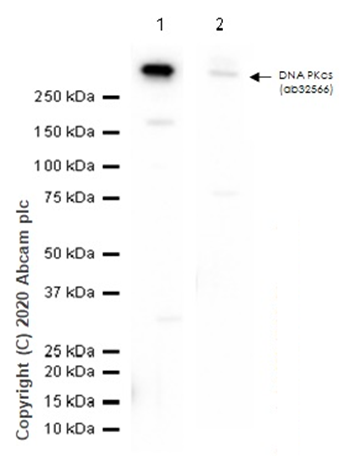
图6.甲醇浓度对转膜效率的影响。
HeLa 全细胞裂解液中 DNA PKcs 蛋白检测
Lane 1:
转膜缓冲液中甲醇浓度 10%
Lane 2:
转膜缓冲液中甲醇浓度 20%
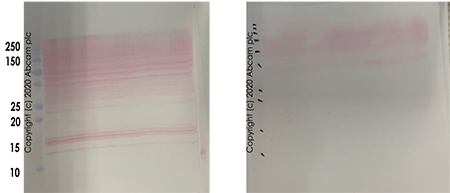
图7.丽春红染色判断转膜是否成功。
左图:转膜成功;右图:转膜失败。
转膜时会特别关注以下小细节:
1 | 对于分子量较大的靶标蛋白,建议在转膜缓冲液中加入 SDS 至终浓度为 0.1%。 |
2 | 对于分子量较大的靶标蛋白,建议使用 0.45μm 的 PVDF 膜。 |
3 | 对于分子量较小的靶标蛋白,建议使用 0.22μm 的 PVDF 膜。 |
4 | 对于分子量较大的靶标蛋白,建议转膜缓冲液中使用 10% 甲醇或更低浓度。 |
5 | 对于分子量较小的靶标蛋白,建议转膜缓冲液中使用 20% 甲醇。 |
6 | PVDF 膜激活完成后充分清洗,完全去除膜上残留甲醇。 |
7 | 转膜开始前请确认胶与膜之间没有任何气泡。 |
8 | 建议转膜完成后使用丽春红染色,确定转膜是否成功(如果选择荧光标记检测,请确保丽春红完全清洗干净)。 |
封闭
封闭是使未有蛋白吸附的区域被封闭,以防止抗体的非特异性结合,从而降低背景,提高检测灵敏度。常用的封闭液有 5% 脱脂奶粉和 5% BSA 或特定封闭液。
小艾在封闭时会特别关注以下小细节:
1 | 没有适用于所有体系的封闭液,请选择合适的封闭液(图8) |
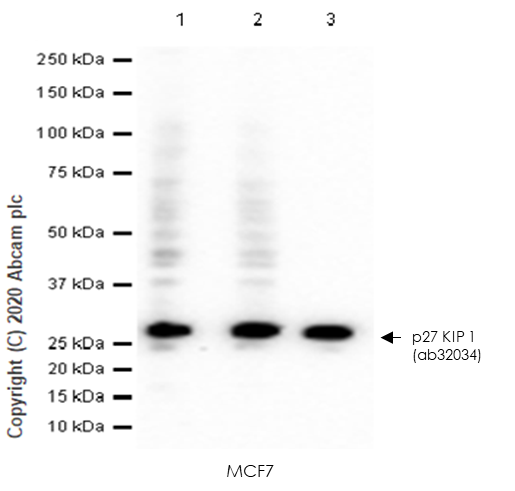
图8.使用 ab32034 检测 p27 KIP1 时,
不同封闭液封闭效果不同。
Lane 1:
2% BSA
Lane 2:
5% BSA
Lane 3:
5% NFDM/TBST
抗体孵育
抗体孵育通常包括一抗孵育和二抗孵育,一抗可特异性地和靶蛋白相互结合;二抗能辨认一抗的恒定区(具有物种特异性),具有放大信号的作用。
小艾在抗体孵育时会特别关注以下小细节:
1 | 在 WB 实验过程中,请避免干膜情况。 |
2 | 请根据产品说明书选择合适的抗体工作浓度。如果不清楚给定的未纯化抗体样品的浓度,请参考表2。 |
组织培养 上清 | 腹水 | 全抗 血清 | 纯化的 抗体 | |
WB | 1/100 | 1/1000 | 1/500 | 1g/ml |
浓度 估计 | 1-3 mg/ml | 5-10 mg/ml | 110 mg/ml |
表2.抗体使用浓度参考表
4 | 建议使用新鲜抗体,不建议抗体重复利用。 |
5 | 抗体孵育时,膜尽量不要裁剪 |
6 | 抗体孵育后充分洗涤,去除非特异性结合 |
检测
二抗通常带有标签,以用作检测。常见检测手段有化学发光和荧光标记等。
小艾在检测时会特别关注以下小细节:
1 | 化学发光检测 ➣ 显色底物的选择,现配现用,避光处理 ➣ 显色底物全覆盖在膜上,避免不均 |
2 | 荧光检测 ➣ 溴酚蓝也会有产生荧光的倾向,最好让它离目的条带远一些 |
以上就是整理的在 WB 实验中需要注意的细节啦!不管你是做哪个靶点,这些技巧都是可以适用的哦!
担心遗漏这些细节点的小伙伴也不要着急,欢迎下载我们为您准备的 WB 实验 check list,边做实验边检查,相信一定会获得满意的实验结果!
文章来源:abcam














